La estequiometría en las reacciones químicas se refiere al estudio de las relaciones cuantitativas entre los reactantes y productos involucrados en una transformación química. Permite determinar las cantidades relativas de sustancias que participan en una reacción y entender cómo se conserva la masa durante el proceso.
Se basa en las proporciones definidas por la ecuación química balanceada que representa la reacción. En una ecuación química balanceada, los coeficientes estequiométricos indican las proporciones relativas de los reactivos y productos. Estos coeficientes muestran la relación en moles, pero también pueden ser utilizados para determinar relaciones en masas, volúmenes o cualquier otra unidad de medida.
A través de cálculos estequiométricos, se pueden responder preguntas como:
¿Cuántos moles de un reactante se necesitan para reaccionar completamente con cierta cantidad de otro reactante?
¿Cuántos gramos de producto se pueden obtener a partir de una cantidad conocida de reactante?
¿Cuál es la concentración final de una sustancia en una reacción química?
¿Cuál es el rendimiento teórico o real de una reacción?
Termodinámica: La termodinámica se ocupa del intercambio y transformación de energía en los sistemas químicos. Estudia conceptos como entalpía, entropía, energía libre y equilibrio químico. La termodinámica es esencial para entender la espontaneidad de las reacciones y la dirección en la que se producen los cambios químicos.
Leyes de la Termodinámica:
Primera Ley de la Termodinámica: La energía total en un sistema aislado se conserva, no se crea ni se destruye, solo se transforma de una forma a otra.
Segunda Ley de la Termodinámica: En cualquier proceso espontáneo, la entropía total del sistema y su entorno siempre aumenta. La entropía se refiere al desorden o aleatoriedad en un sistema.
Tercera Ley de la Termodinámica: Es imposible alcanzar el cero absoluto (-273.15 grados Celsius) en un número finito de pasos. Establece una temperatura mínima absoluta y la relación entre temperatura y entropía.
Ley Cero de la Termodinámica: Si dos sistemas están en equilibrio térmico con un tercer sistema, entonces también están en equilibrio térmico entre sí. Proporciona la base para la medición de la temperatura y establece la noción de equilibrio térmico.
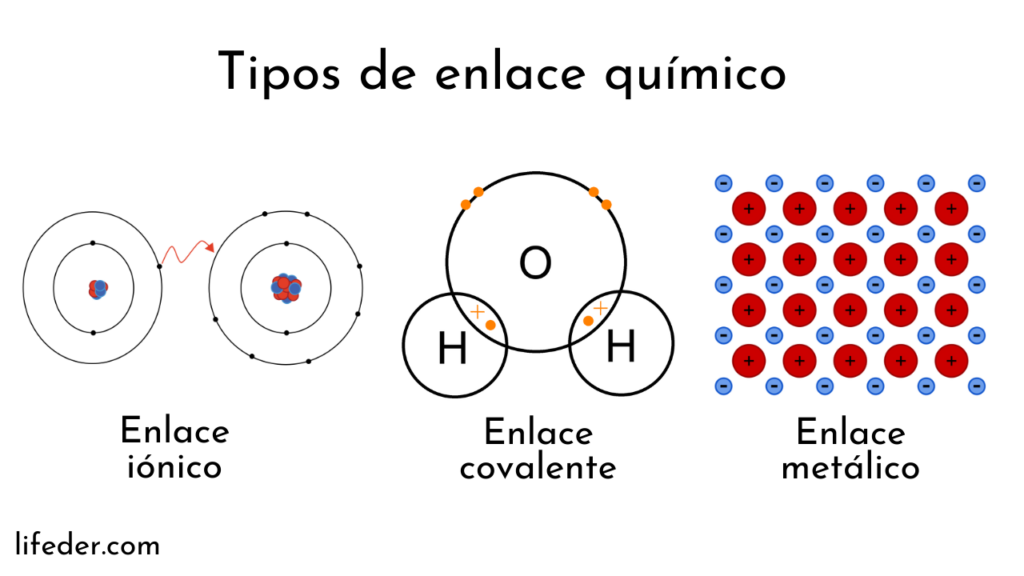
Enlaces Químicos